En la antigüedad se conocían elementos como el oro, la plata, el cobre, el estaño, el plomo y el mercurio, pero el primer hallazgo científico de un elemento lo hizo Hennig Brand (h. 1630-h. 1710) en 1669, cuando descubrió el fósforo.
Más adelante, en el siglo XIX, los químicos tuvieron la necesidad de ordenar los elementos descubiertos. La primera forma de hacerlo, la más natural, fue la de clasificarlos por masas atómicas, pero esta jerarquización no reflejaba las diferencias y similitudes entre los elementos. Muchas más formas de organizar los elementos fueron adoptadas antes de llegar a la tabla periódica que se utiliza actualmente y que aquí describiremos. Para ello, mostraremos el desarrollo cronológico de las diferentes clasificaciones de los elementos químicos.

JOHANN WOLFGANG DÖBEREINER (1780-1849)
Este químico alcanzó a elaborar, en 1817, un informe que mostraba la relación entre la masa atómica de ciertos elementos y sus propiedades. Destacó la existencia de similitudes entre elementos agrupados en tríos, que denominó tríadas: la tríada del cloro, el bromo y el yodo, por ejemplo. Döbereiner demostró que la masa de uno de los tres elementos de la tríada es intermedia entre las de los otros dos. En 1850 se contaba ya con unas 20 tríadas para llegar a una primera clasificación coherente.
ALEXANDRE-ÉMILE BÉGUYER DE CHANCOURTOIS (1820-1886) Y JOHN NEWLANDS (1837-1898)
En 1862, Alexandre-Émile Béguyer de Chancourtois, geólogo francés, puso en evidencia una cierta periodicidad entre los elementos hasta el momento registrados. Dos años más tarde, al lado del químico inglés John Newlands, postuló la ley de las octavas,1 en la que describía que las propiedades se repiten cada ocho elementos. Pero esta ley no puede aplicarse a los elementos más allá del calcio. Esta clasificación es, por lo tanto, insuficiente; aun así, la tabla periódica comenzaría a ser diseñada.
JULIUS LOTHAR MEYER (1830-1895)
En el año 1869, este químico alemán puso en evidencia una cierta periodicidad en el volumen atómico, pues los elementos semejantes tienen un volumen atómico también similar, en relación con los otros elementos.

DIMITRI IVANOVICH MENDELEYEV (1834-1907)
También en 1869, este químico ruso presentó una versión inicial de su tabla periódica. Ésta fue la primera presentación coherente de las semejanzas de los elementos, pues Mendeleyev se dio cuenta de que, clasificándolos según sus masas atómicas, aparecía una periodicidad en lo que concierne a algunas de sus propiedades. La primera tabla contenía 63 elementos y fue diseñada a partir de la periodicidad de cada uno de ellos. De esta manera fueron clasificados verticalmente, en tanto que las agrupaciones horizontales se suceden representando los elementos de la misma «familia».
Para aplicar la ley que creía cierta, Mendeleyev tuvo que dejar ciertos huecos. Estaba convencido de que, un día, esos lugares vacíos no lo estarían más; los descubrimientos futuros confirmaron su convicción. Consiguió, además, prever las propiedades químicas de tres de los elementos que faltaban, que nombró eka-aluminio, eka-boro y eka-silicio —del sánscrito, que significa «semejante a»—, a partir de las propiedades de los cuatro elementos vecinos.
Entre 1875 y 1886 fueron descubiertos tres elementos más que, en efecto, poseían las propiedades predichas: galio —eka-aluminio—, escandio —eka-boro— y germanio —eka-silicio.

HENRY MOSELEY (1887-1915)
Aunque la clasificación de Mendeleyev marcó un claro progreso, su tabla no era del todo correcta, de modo que, después de que se descubrieron varios elementos nuevos y de que las masas atómicas pudieron determinarse con mayor exactitud, se hizo evidente que algunos de esos elementos no estaban en el orden adecuado.
La causa del problema la determinó el químico inglés Henry Moseley, al descubrir que los átomos de cada elemento tienen un número único de protones en sus núcleos que debe ser igual al número atómico del átomo.
Cuando organizó los elementos en orden ascendente por número atómico y no en orden ascendente por masa atómica, como lo había hecho Mendeleyev, se solucionaron los problemas y esta nueva clasificación por número atómico generó un claro patrón periódico de propiedades.
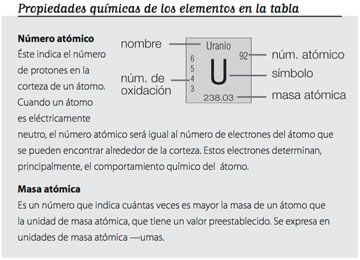
1.Newlands adoptó este nombre de la escala musical, debido a que si partimos de una nota específica, como fa, la volveremos a encontrar ocho notas más adelante —aunque más alto o más bajo por una octava— y lo mismo sucede con los elementos químicos. N. del E.
Sigue aprendiendo con Algarabía
Margaret Hamilton. La mujer que guio al apolo 11
Top 10: Supercomputadoras
Louis Pasteur














